Adv Sci | 中山三院何留民/戎利民团队通过机械调节Il11ra1/Itga11成纤维细胞靶向瘢痕促脊髓损伤轴突生长
以下文章转载自iNature,作者一柚
纤维化瘢痕仍然是脊髓损伤 (SCI) 后轴突再生的关键障碍。目前的策略主要集中在去除细胞外基质 (ECM) 成分,而忽略了其在维持组织完整性方面可有可无的作用。
与脊髓强度匹配的机械强度可诱导成纤维细胞排列,将纤维化瘢痕重塑为平行基质,而与脊髓强度不同的机械强度则无法做到这一点。机械研究发现了一个先前未知的 Il11ra1+/Itga11+ 成纤维细胞亚群,该亚群通过机械转导信号级联 LRP6/β-Catenin/MMP7 与排列浸润和平行 ECM 密切相关,从而促进轴突再生并增强病变区域内的神经连接。该研究揭示了通过操纵纤维化疤痕的细胞成分来重塑纤维化进展的机械转导机制,为发现解决脊髓损伤后纤维化的潜在治疗靶点提供了新的见解。

由于细胞外基质蛋白由驻留细胞(主要是高分泌成纤维细胞)分泌,脊髓损伤后细胞表型和功能的改变在纤维化进展中起着至关重要的作用。在此背景下,关注环境因素而非单个分子诱导的细胞反应的方法可能为阐明脊髓损伤后纤维化瘢痕形成机制提供更有利的替代方案。细胞外基质清除的程度尚未确定,且难以掌握。因此,其临床转化潜力尚不明确。迫切需要对纤维化调控机制的新认识,以制定治疗纤维化瘢痕的策略。最近的进展突出了响应纤维化及其瘢痕形成的机械转导途径的演变,其中机械转导将机械力转化为生化刺激,并对多种病理生理过程产生影响。因此,从机械生物学的角度来看,机械医学概念在纤维化治疗中的应用前景广阔。
在本研究中,作者将由透明质酸-接枝物-多巴胺 (HADA) 和设计肽 HGF-(RADA)4-DGDRGDS (HRR) 组成的不同机械强度的整合水凝胶移植到脊髓损伤 (SCI) 病变中,并研究了机械转导对脊髓损伤后纤维化的影响。本研究旨在揭示机械转导在纤维化中发挥作用的分子机制,并为解决脊髓损伤后纤维化瘢痕提供潜在的治疗靶点。此外,作者的研究也可能为发现对抗纤维化和瘢痕形成的潜在治疗干预措施提供参考。
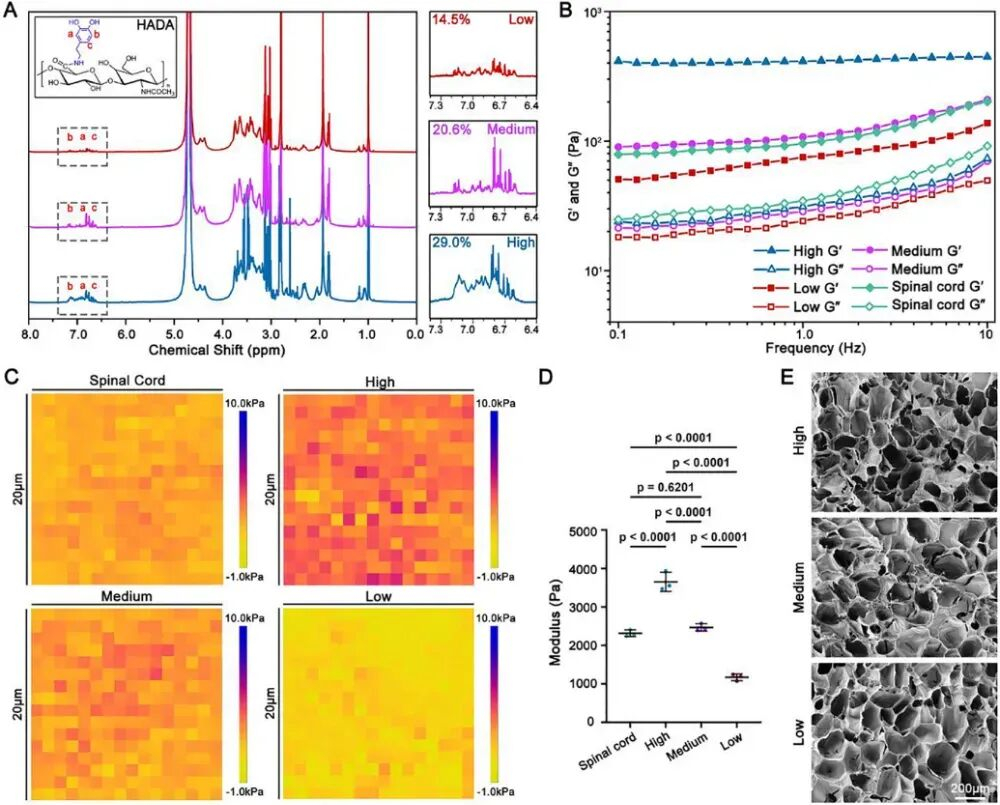
图1具有机械强度梯度的HADA/HRR水凝胶的制备和表征。(图源自Advanced Science)









