【中心科研】Nature Aging丨中山三院脑病中心陆正齐团队揭示大脑衰老新机制,为“治未病”提供精准干预靶点
伴随全球人口老龄化加剧,神经退行性疾病业已成为威胁老年人健康的主要威胁。其中,阿尔茨海默病、帕金森病等疾病在造成病患认知与运动功能丧失的同时,还给家庭和社会带来沉重的负担。目前,针对神经退行性疾病的治疗仍以缓解症状为主,缺乏根本性的早期干预手段。中山三院脑病中心神经内科陆正齐教授、蔡蔚副研究员联合中山大学肿瘤防治中心刘强教授团队于2025年9月10日在国际知名期刊Nature Aging(中科院一区,Top)上发表最新研究,首次揭示了脑内免疫细胞通过“迁移体”传递衰老信号的机制,为阻断神经退行性病变的早期进程提供了全新策略。

原文链接 https://www.nature.com/articles/s43587-025-00956-5
关键发现
边界巨噬细胞的异常活化与迁移体释放加速脑老化进程
研究团队聚焦于脑内重要的免疫屏障细胞——边界相关巨噬细胞(BAMs),此类细胞分布于脑—脑脊液和脑—血屏障界面,是维持大脑稳态的“边防卫士”。然而,在衰老或早期神经退行性变的病理状态下(如β淀粉样蛋白/Aβ累积),BAMs功能发生异常,其不仅呈现衰老样表型(功能衰退、炎症因子分泌增加),还大量生成一种称为“迁移体”的特殊细胞器。迁移体作为细胞间通讯的“快递包裹”,在该研究中被首次发现其可携带衰老相关信号分子(AIM蛋白),并从BAMs传递至小胶质细胞(大脑固有免疫系统的免疫清除者)。
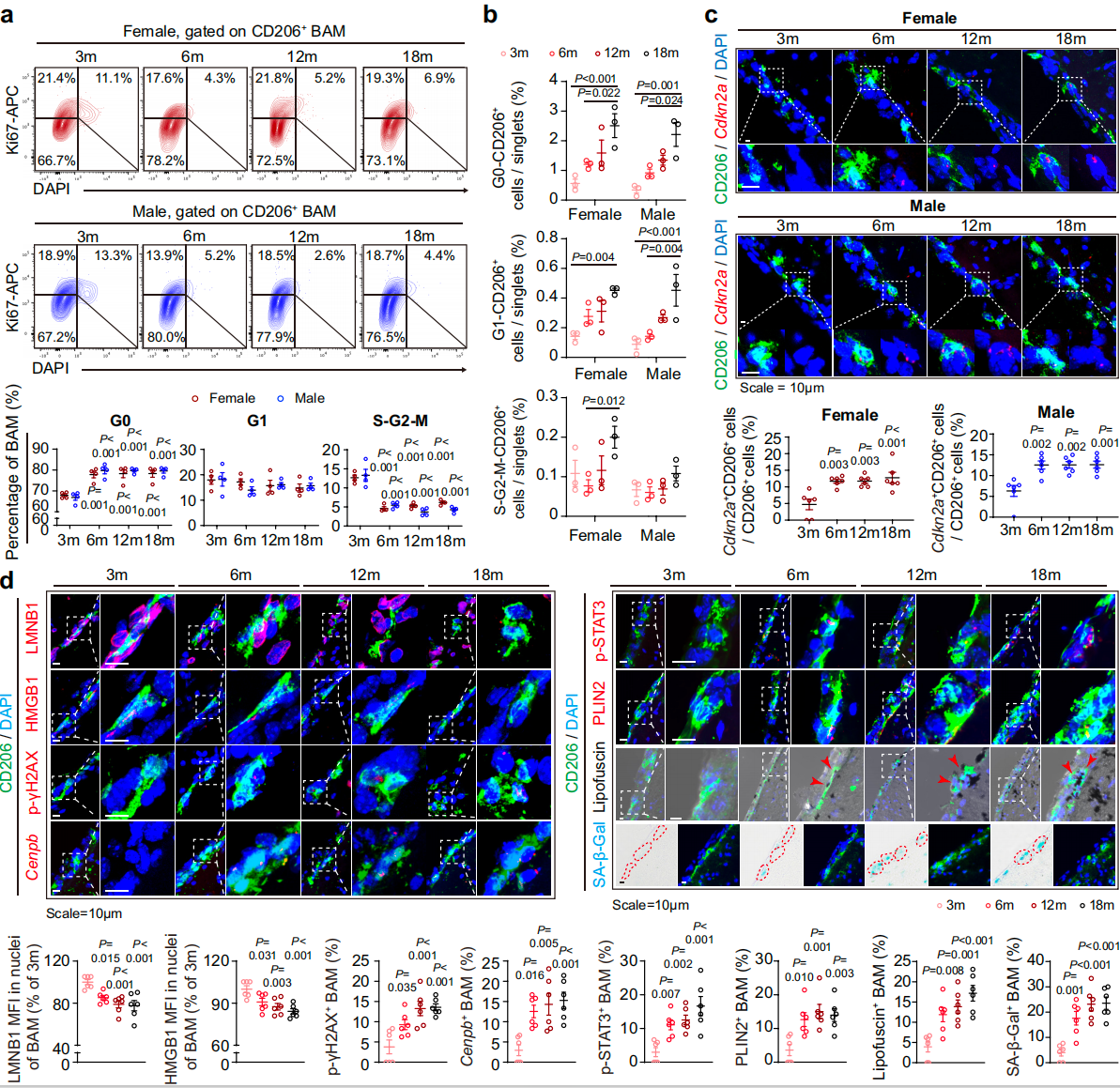
图1. BAMs在大脑衰老过程中发挥主导作用
衰老信号的“级联放大”:从局部免疫紊乱到全脑微环境恶化
研究团队通过高分辨率成像和分子追踪技术证实,迁移体被小胶质细胞摄取后,其携带的AIM蛋白通过激活CD16受体,触发小胶质细胞的双重反应:一方面加剧其衰老和炎症状态,另一方面抑制其对淀粉样蛋白、髓鞘碎片等的清除。这种放大效应会形成恶性循环,导致神经炎症扩散、神经元功能受损,最终引发认知障碍。该机制揭示了衰老信号在脑内的动态传播路径,为理解多种神经退行性疾病的共性病理过程提供了新视角。
精准干预:靶向迁移体,逆转衰老相关认知缺陷
基于上述机制,团队开发了一种靶向TSPAN4(迁移体形成关键蛋白)的siRNA脂质体。在老年小鼠模型中,该干预显著抑制了BAMs迁移体的生成,阻断了衰老信号向小胶质细胞的传递。治疗后,小鼠脑内免疫衰老标志物减少、Aβ沉积下降,认知功能得到显著改善。这种靶向特定细胞器的新型干预策略,避免了传统广谱抗炎或细胞清除疗法的局限性,为临床实现精准神经保护提供了可能。
未来展望
从“治已病”到“治未病”的范式转变
该研究发现迁移体作为可调控的衰老信号载体,为阿尔茨海默病、帕金森病等疾病的早期干预提供了窗口期。未来或可开发血液或脑脊液中迁移体相关标志物的检测方法,实现疾病的超早期预警。在脑健康领域,通过阻断衰老信号的传播链,有望延缓甚至预防神经退行性疾病的发生。这与中医“未病先防”的理念高度契合,也为现代医学的精准预防提供了范例。
研究提示,针对免疫微环境的调控可能是维持老年脑健康的关键所在。未来可探索如生活方式干预、免疫调节药物等的联合治疗策略,从多维度改善衰老对脑健康的损害。
目前,团队正优化靶向递送系统,大力推动研究成果向临床转化。未来,我们有望通过早期筛查和精准干预,让更多老年人享有高质量的晚年生活。
研究团队
该研究由中山三院神经内科团队主导,联合中山大学肿瘤防治中心合作完成,是神经退行性疾病研究领域的重要突破。陆正齐教授、蔡蔚副研究员与刘强教授担任通讯作者;胡梦颜博士后、康新梅博士后及刘芷若硕士研究生为共同第一作者。
通讯作者

第一作者










